醋酸解离常数的测定
一、实验目的
1.了解酸度计测定醋酸解离常数的原理和测定方法。
2.进一步理解并掌握解离平衡的概念。
3.熟悉酸度计的使用方法。
二、实验原理
本实验通过测定不同浓度的醋酸的PH来球算醋酸的标准解离常数。
醋酸在水中存在下列解离平衡:HAc==H++Ac-
在一定的温度下,这个过程很快达到了平衡,平衡常数的表达式为:
K= [H+][Ac-]/[HAc]
式中 [H+]、[Ac-]、[HAc]分别为H+、Ac-、HAc的平衡浓度。
在一定温度下,用酸度计测定一系列已知浓度的醋酸溶液的PH,根据PH=-lg[H+],可换算出相应的C(H+),将C(H+)的不同值代入上式,可求出一系列对应的K(HAc)值,取其平均值,即为该温度下醋酸的解离常数。
三、仪器和药品
仪器:酸度计(其配套的指示电极是玻璃电极),酸式滴定管,小烧杯
药品:醋酸溶液(0.1mol/L)
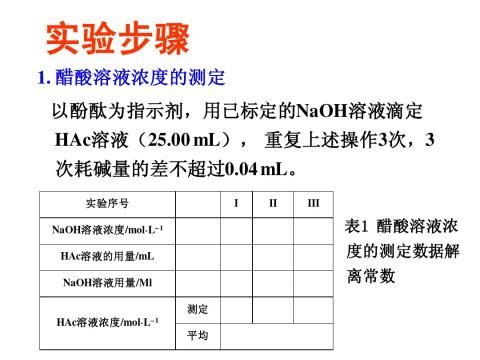
四、实验步骤
1.配制不同浓度的醋酸溶液
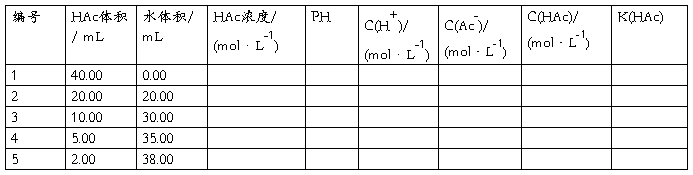
将5只烘干的小烧杯,用滴定管依次加入已知浓度的醋酸溶液40.00mL,20.00mL,10.00mL,5.00mL,和2.00mL,再从另一滴定管中依次加入0.00mL,20.00 mL,30.00 mL,35.00 mL和38.00 mL蒸馏水,并分别搅拌均匀。
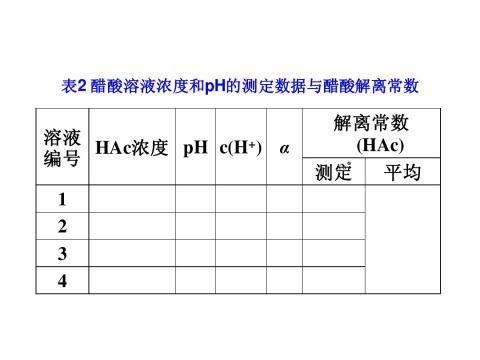
2.醋酸溶液PH的测定
3.计算醋酸溶液的(标准)解离常数K(HAc)
根据实验数据计算出各溶液K(HAc),求出平均值。
由实验可知:在一定的温度条件下,醋酸的解离常数为一个定值,与溶液的浓度无关。
五、数据处理
六、思考
实际测得的K与附表中的解离常数存在一定差距,那么怎样减少误差?
第二篇:pH 法测定醋酸解离常数